Pro-Med ti aiuta ad entrare nella facoltà dei tuoi sogni 🥳 Negli ultimi 8 anni abbiamo aiutato più di 20.000 studenti ad entrare a Medicina, Odontoiatria, Veterinaria e Professioni Sanitarie, con recensioni fuori dal comune. Con tutti i nuovi cambiamenti in ballo potresti aver bisogno di un percorso di preparazione strutturato, che ti aiuti a studiare la teoria, a fare la pratica e ad ottenere il massimo dalla banca dati 👨🏻🏫 Leggi di più sui nostri Corsi > 📍 Leggi di più sulle nostre Lezioni individuali> Acquista le nostre risorse di studio autonomo: 🤖 Leggi di più sui nostri pacchetti di Simulazioni (statale e private) > 📚 Leggi di più sui nostri Manuali >
Ciao, oggi voglio aiutarti con uno degli argomenti più temuti di sempre: come capire se una molecola è polare o apolare.
Scommetto che solo a sentirne parlare ti sale la nausea.
Tranquillo, oggi ci pensiamo noi a toglierti un peso.
Siamo studenti esattamente come te, ci siamo passati e, proprio per questo, crediamo di poterti dare dei consigli preziosi!
Vedrai che, leggendo fino alla fine, sarà tutto molto più chiaro, promesso!
Prima di iniziare però, ti do un consiglio: chiediti se sai rispondere correttamente alle seguenti domande:
- So rappresentare nel modo corretto una molecola con la struttura di Lewis?
- Ho ben chiara la differenza tra coppia di elettroni di legame e doppietto non condiviso?
Se hai risposto “no” ti consiglio di rivedere i concetti citati e di allenarti fino a quando ti risulteranno familiari, in quanto continuare a leggere ti confonderà solo le idee e sarà un’inutile perdita di tempo.
Spesso ci ostiniamo a saltare le basi per andare subito a studiare gli argomenti più difficili. Niente di più sbagliato.
Ricordati: mai sottovalutare le basi. E’ uno dei consigli migliori che ti possiamo dare per avere successo il giorno del test.
Se invece sai già qualcosa a riguardo, questi trucchetti possono davvero aiutarti a rispondere ad alcuni quesiti che spesso capitano nei test, del tipo:
la molecola XY è polare? Che forma ha?
Partiamo, ecco di cosa parleremo:
- Numero sterico: cos’è?
- Alcuni esempi guidati
- Consigli e strategie per determinare la polarità
- Vocabolario della dispensa e concetti principali
1. Numero sterico: cos’è?
Iniziamo con la definizione di numero sterico come:
n° di atomi legati all’atomo centrale + n° di coppie solitarie di elettroni dell’atomo centrale
Associamo genericamente delle lettere a questi “fattori” in modo da ottenere un’espressione di questo tipo:
A= atomo centrale
X= atomi legati con legame covalente all’atomo centrale (n sarà il numero di questi atomi)
E= coppie di elettroni libere presenti sull’atomo centrale (m sarà il numero di queste coppie)
Riassumendo:

! Anche se ci sono doppi legami tra l’atomo centrale e gli atomi legati ad esso, si conta sempre 1 per ogni legami che c’è (esempio: c’è un triplo legame e lo conto come 1, non come 3).
! Nella scrittura di quest’espressione ci interessano solo le coppie solitarie presenti sull’atomo centrale, non quelle che eventualmente ci sono sugli altri atomi della molecola.
! Ogni doppietto solitario conta come 1 in quanto si contano le coppie e non i singoli elettroni (in poche parole:1 coppia di elettroni=1)
2. Alcuni esempi guidati
CO2
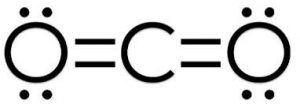
Come puoi vedere dalla struttura di Lewis, ci sono due atomi (i due ossigeni) legati all’atomo centrale (carbonio) quindi il primo pezzo dell’espressione sarà AX2. Poi mi chiedo se sono presenti coppie solitarie di elettroni sull’atomo centrale.
Attenzione a non confonderti! Sull’atomo centrale (carbonio) non ci sono coppie libere, ci sono invece sugli ossigeni ma questo non ci interessa perchè gli ossigeni non sono l’atomo centrale della molecola. Per cui il resto della nostra espressione sarà E0 o semplicemente puoi non scriverlo e indicare solo AX2.
NS (numero sterico)=2+0=2
H2SO4
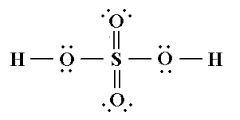
Come noti sono presenti 4 atomi (4 ossigeni) legati a quello centrale (S), per cui la parte iniziale del la nostra espressione sarà AX4. Non ci sono doppietti elettronici presenti sull’atomo centrale quindi possiamo lasciare l’espressione così oppure scrivere E0.
NS (numero sterico) = 4+0=4
NH3

In questo caso sono presenti tre atomi (tre idrogeni) legati a quello centrale (N). Per cui iniziamo a scrivere AX3. E’ presente un doppietto solitario sull’atomo centrale per cui scriveremo E1. La nosrea espressione sarà quindi AX3E1.
NS (numero sterico) =3+1=4
3. Consigli e strategie per determinare la polarità
Come possiamo collegare il concetto di numero sterico alla polarità di una molecola?
Ecco alcuni trucchetti e consigli:
- Se siamo nel caso di AX4 AX3 AX2 ,quindi in assenza di coppie di elettroni solitarie e gli atomi legati a quello centrale sono uguali tra loro allora la molecola sarà apolare, in quanto i legami ( e quindi i dipoli ) si annulleranno geometricamente a vicenda (essendo tutti della stessa “forza”). Se invece, sempre nel caso di queste espressioni, c’è anche solo un atomo diverso, la molecola sarà polare perché non si annulleranno geometricamente i dipoli (in quanto diversi).
- Se siamo in presenza di coppie di elettroni solitarie la situazione cambia in quanto proprio la presenza di doppietti sull’atomo centrale esercita una specie di repulsione sugli altri elettroni (cariche uguali tendono ad allontanarsi) e il risultato sarà una forma diversa della molecola, per esempio piegata o angolata. Per questo motivo tutte le molecole che hanno coppie di elettroni non condivisi sull’atomo centrale sono polari, a prescindere dagli atomi legati a quello centrale. (Valido per AX3E1 AX2E2 AX2E1).
Ritornando agli esempi di prima potremo quindi affermare che:
–CO2 è apolare in quanto la sua espressione è AX2 , con atomi uguali legati a quello centrale.
–H2SO4 è apolare in quanto la sua espressione è AX4 e gli atomi legati a quello centrale sono tutti uguali.
–NH3 è polare in quanto la sua espressione ha una coppia solitaria e di conseguenza la molecola è polare.
Ti allego anche una tabella molto molto utile che a questi concetti unisce la forma che una molecola avrà. Puoi provare a calcolarti il numero sterico e, in base a questo, a posizionarti nella tabella proseguendo poi in relazione al numero di coppie solitarie presenti: arriverai alla forma della molecola.

4. Vocabolario della dispensa e concetti principali
numero sterico: numero utile per risolvere questo tipo di quesiti, ottenuto dalla somma del numero di atomi legati all’atomo centrale (X) e il numero di coppie solitarie di elettroni (E) presenti sull’atomo centrale
coppie solitarie: anche chiamate “doppietti solitari”, sono coppie di elettroni non impegnate in nessun legame chimico
polare: molecola che presenta una carica parziale positiva da una parte e una parziale negativa dall’altra
apolare: molecola che non presenta cariche parziali positive o negative
Dispensa in poche righe:
Per determinare se una molecola è polare o apolare il mio consiglio è quello di partire dalla determinazione del numero sterico, ovvero quel numero che puoi ottenere sommando gli atomi legati all’atomo centrale e il numero di coppie solitarie di elettroni presenti sull’atomo centrale. Dalla somma puoi ottenere diverse combinazioni, che ti aiuteranno a decidere se la molecola è effettivamente polare, in base a tutte le varie situazioni sopra elencate.
Spero di averti aiutato, a presto!
Pro-Med Family









